Bohr Atom Modeli Nedir? Özellikleri Nelerdir, Neyi Savunmuştur?

Maddenin yapısını ve maddenin nelerden meydana geldiği ile ilgili soruları yanıtlamak için bilim insanları geçmişte pek çok çalışmalar yapmıştır. Bohr atom modeli 1913 yılında Rutherford atom örneğinin eksik yönlerini gidermek için oluşturulmuştur.


Ayrıca bu atom modeli Balmer'ın atomu çeşitliliğine ait bulduğu yöntemi açıklamak için Eınstein'ın foton kurumlarını ve Planck'ın kuantum modelini değerlendirerek oluşturulmuş bir model olmaktadır.
Bohr Atom Modeli Nedir?
Danimarkalı bilim adamı olan Niels Hendrik Bohr aracılığı ile 1913 yılında ortaya atılmış olan atom modeline Bohr atom modeli adı verilmektedir. Günümüzde Modern Atom Modeli kabul edilmektedir. Bu teoriye en yakın model olarak sayılmaktadır. Niels Hendrik Bohr Eınstein'ın Foton ve Planck'ın kuantum kuramlarını kullanmıştır. Bu şekilde de bu atom modeli ortaya çıkmıştır.
Atom kuramları birbirinin devamı şeklindedir. Ruhterford atom kuramını takip eden kuram Hendrik Bohr olmaktadır. Burada Bohr gerçekleştirdiği çalışmalarda çekirdek çevresinde elektronların hareketleri sonucunda enerjilerinin tükenmeleri ve çekirdek içine düşmeleri gerekli olduğunu saptamıştır.
Rutherford ise elektronların çekirdek çevresindeki hareketleri ile ilgili yeterli bilgiyi sunmamaktadır. Bohr bu eksikliğin farkına varmış ve hidrojen atomlarının çeşitliliklerini tarayarak atomların yörüngelerdeki hareketini yorumlamaktadır.


Bohr Atom Modeli Özellikleri Nelerdir?
Bohr atom modelinin özellikleri şunlardır:
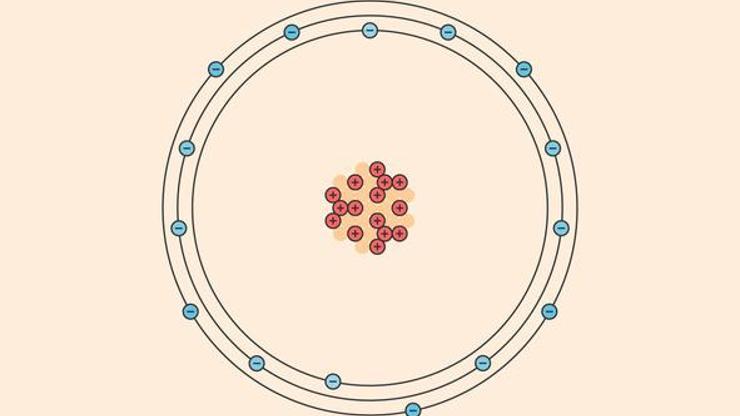
- Atomda bulunan elektronlar çekirdekten belli uzaklıkta ve kararlı halde hareket ederler. Her kararlı hain sabit bir enerjisi de bulunmaktadır.
- Herhangi bir enerji seviyesinde elektronlar dairesel bir yörüngede hareket etmektedir. Yörüngelere enerji düzeyleri veya kabukları adı verilir.
- Elektronlar kararlı olarak birinde bulunurken atomdan radyasyon yayılmamaktadır. Fakat yüksek enerji düzeyinden düşük enerji düzeyine geçtiğinde seviyeler arasındaki enerji farkına eşit olarak ışık kuantı yayınlar.
- Elektron hareketinin kararlı seviyeleri K, L, M, N, O harfleri ile ya da en düşük enerji düzeyi 1 olmak üzere her enerji düzeyi pozitif tam sayı ile belirlenmektedir. Bu da genellikle ''n'' ile gösterilir.
Bohr Atom Modeli Neyi Savunmuştur?
Bohr atom modeline göre elektronlar çekirdek belli uzaklıklarda dairesel yörüngeler izlemektedir. Çekirdeğe en yakın yörüngede olan K tabakası ise en düşük enerjili olmaktadır. Çekirdekten uzaklaştığında tabakanın yarıçapı ve kabukta yer alan elektronun enerjisi artmaktadır. Elektron çekirdekten sonsuz uzaklıkta olduğunda elektronlar çekirdek arasındaki çekim kuvveti bulunmamaktadır. Bu olayın adı iyonlaşma olmaktadır.


Elektron çekirdeğe yaklaştığında ise çekme kuvveti oluşur. Böylece elektronun bir potansiyel enerjisi oluşmaktadır. Elektron çekirdeğe yaklaştığında arım kararlı olur ve potansiyel enerjisi azalmaktadır. Bu durumda elektronun her enerji düzeyindeki potansiyel enerjisi sınırdan küçük olmaktadır.


SON DAKİKA
EN ÇOK OKUNANLAR


K2 Tipi Cezaevi Nedir? Hangi Suçlular Kalır? Özellikleri Nelerdir?

B Tipi Cezaevi Nedir? B Tipi Cezaevinde Kimler Yatar? Hangi Suçları Kapsar?

A Tipi Cezaevi Nedir? A Tipi Cezaevinde Kimler Yatar? A Tipi Cezaevi Hangi Suçları Kapsar?

M Tipi Cezaevi Nedir? M Tipi Cezaevi Kimler Yatar? Hangi Suçları Kapsar?

E Tipi Cezaevi Nedir? E Tipi Cezaevinde Hangi Suçlular Yatar? Hangi Suçları Kapsar, Özellikleri Nelerdir?











